Pandémie : recherches, vaccins et peurs
Cette nouvelle pandémie due au virus COVID-19 suscite, avec raison, beaucoup de craintes quant à sa contagion et à sa dangerosité. Les informations décousues, parfois contradictoires, de la Santé publique et/ou des gouvernements ne facilitent ni la compréhension ni l’adhésion à la collaboration aux mesures sanitaires
Nous allons faire brièvement le tour du déroulement d’une recherche, d’une autorisation fédérale de Santé Canada, du développement d’un vaccin, du suivi de ce même vaccin et du virus lui-même. Nous espérons que cet article apportera quelques lumières sur le processus décisionnel et favorisera la collaboration de la population au maintien de sa santé. Les messages ne reflètent pas toujours la réalité.
Comment se déroule une recherche
L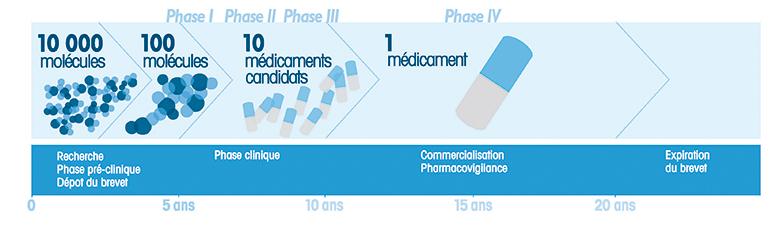 orsqu’une compagnie entame une recherche, c’est en général pour répondre à un besoin de santé. Nous ne discuterons pas ici de la volonté de la compagnie d’augmenter ses profits ou la valeur de son action. On cible d’abord un problème de santé et l’on tente d’identifier et de produire une molécule pour contrer, idéalement guérir, une maladie ou la situation sanitaire identifiées : pensons aux médicaments anti-hypertenseurs ou hypocholestérolémiants.
orsqu’une compagnie entame une recherche, c’est en général pour répondre à un besoin de santé. Nous ne discuterons pas ici de la volonté de la compagnie d’augmenter ses profits ou la valeur de son action. On cible d’abord un problème de santé et l’on tente d’identifier et de produire une molécule pour contrer, idéalement guérir, une maladie ou la situation sanitaire identifiées : pensons aux médicaments anti-hypertenseurs ou hypocholestérolémiants.
Un comité d’éthique vérifie ensuite le protocole établi et, s’il est approuvé, il est mis en marche : population cible, nombre de candidats, conditions du suivi, consentement éclairé, etc. Il y a une règle de base, mais pas nécessairement infaillible, que l’on doive suivre 5 000 personnes durant six ans ou 6 000 personnes durant cinq ans pour obtenir des données dites significatives.
Le médicament mis en marché est suivi continuellement car il n’est pas rare que certains effets secondaires nouveaux soient notés après la rédaction d’ordonnances de centaines de millions de comprimés. On voit alors apparaître des notes dites « avertissement » en cours de route. Parfois, ce sont de nouvelles indications ou même des effets secondaires significatifs au point où le retrait du médicament s’impose malgré toutes ces étapes de prudence. Rappelons-nous ici le retrait du Vioxx et du Bextra, deux puissants anti-inflammatoires à l’origine d’hypertension artérielle ou de maladies cardiaques.
Enfin, on réoriente parfois certaines recherches en cours de route. Pensons au Viagra développé à l’origine comme un vasodilatateur coronarien. Les patients de l’étude, ayant mentionné une érection de quelques heures, ont été à l’origine d’une modification du protocole. Exit la vascularisation coronarienne et bienvenue la dysfonction érectile, pour laquelle l’arsenal thérapeutique était alors limité.
Santé canada
Santé Canada est le ministère fédéral qui autorise la commercialisation d’un produit. Avant cette autorisation, le fabricant doit présenter une preuve scientifique substantielle (études) de l’innocuité, de l’efficacité et de la qualité du produit, tel que requis par la loi sur les aliments et drogues. Tous les produits doivent passer par le biais du processus d’examen des médicaments. La demande est examinée par le personnel scientifique de la Direction générale des produits de santé et des aliments, la DGPSA. Cette autorisation est aussi une mesure de protection pour les produits novateurs et leur propriété intellectuelle.
Un arrêté d’urgence (différente d’une autorisation préalable) peut aussi s’appliquer pour accélérer l’obtention d’une autorisation pour l’importation, la vente ou la publicité d’un médicament. Le Ministre utilise cette procédure s’il estime qu’une intervention immédiate est nécessaire afin de parer à un risque important (direct ou indirect) pour la santé, la sécurité ou l’environnement. Cette procédure est valide pendant 14 jours; si un décret s’ajoute, la durée de la procédure est d’un an. C’est l’approche qui a été suivie pour l’homologation des vaccins pour le COVID-19. Santé Canada fait le suivi quant à l’efficacité et l’innocuité du produit. Ce ministère peut annuler en tout temps les autorisations ou les licences d’établissement accordées s’il le juge nécessaire.
Les vaccins
Le vaccin est une préparation administrée pour provoquer l’immunité contre une maladie en stimulant la production d’anticorps. Ce peut être une suspension de micro-organismes inactivés ou atténués, ou des produits dérivés de micro-organismes. Il peut être disponible en pulvérisation nasale, en formulation intramusculaire ou orale. Le suivi des vaccins est fait par Santé Canada et aussi par les compagnies fabriquant le produit.
Les vaccins contre la COVID-19 ont eu des études de plus courte durée en raison de la situation sanitaire urgente. Il n’est donc pas surprenant que les effets secondaires apparaissent progressivement et au compte-gouttes, entraînant des mises à jour avec une grande variabilité quant au contenu et à l’intensité des réactions. Voici des exemples de modifications réelles suite aux rapports quotidiens du suivi des vaccins :
- 2 avril 2021 : La FDA (Food and Drug Administration) autorise Moderna à produire des fioles de 15 ml au lieu de 10 ml. La FDA autorise 11 vaccins au lieu de 10 avec la fiole de 10 ml. Une seringue spéciale est utilisée : elle utilise un espace mort diminué à sa sortie à la base de l’aiguille.
- 5 avril 2021 : Pfizer peut diminuer la température de conservation de son vaccin de - 60 °C à – 80 °C durant 6 mois à – 13 °C à + 5 °C pendant deux semaines.
- Les comparaisons directes entre les trois principaux vaccins ne peuvent être faites parce qu’il n’y a pas eu d’études effectuées concurremment et selon le même protocole.
- 5 avril 2021 : Plus de quinze millions de doses du vaccin de Johnson et Johnson (JJ) ont dû être jetées. Les vaccins de JJ et d’Astra Zeneca (AZ) étaient produits dans la même usine, celle de Emergent Biosolutions’. Des opérateurs ont mélangé les ingrédients des deux fabricants. JJ a pris la responsabilité de faire le ménage et AZ a déménagé ailleurs sa production.
- 6 avril 2021 : AZ suspend son étude chez les enfants et les adolescents.
- 6 avril 2021 : Les anticorps de Moderna persistent durant six mois après la 2e injection chez les jeunes et les adultes mais diminuent chez les personnes âgées de 56 ans et plus.
- 7 avril 2021 : EMA (l’Agence européenne du médicament, équivalent européen de la FDA aux États-Unis et de Santé Canada) mentionne des effets secondaires très rares, à savoir des caillots sanguins déclenchés par l’héparine.
- 8 avril 2021 : Les vaccins sont mentionnés comme moins efficaces chez les populations âgées et fragiles dans les CHSLD (Centre hospitalier de soins de longue durée) et les RPA (Résidence pour Aînés). Ceci n’est pas surprenant car ces populations n’ont pas fait partie des études sur les vaccins et aussi ces populations ont une capacité diminuée de produire des anticorps et de construire une réaction immunitaire. Cette protection sous-optimale pourrait expliquer la réinfection dans les CHSLD et RPA.
- 10 avril 2021 : On se pose la question à savoir si l’on peut, en deuxième dose, utiliser un vaccin à ARN chez les moins de 55 ans…?
- 15 avril 2021 : Des études en Israël ont démontré des effets secondaires sous forme de réactivation du zona chez des personnes avec une comorbidité inflammatoire ou auto-immune. La population israélienne sera « sous une grosse loupe » parce qu’elle a été vaccinée rapidement, dans une grande proportion, et qu’elle a abandonné les masques le 8 avril 2021.
- 20 avril 2021 : EMA mentionne un lien possible de caillots avec le vaccin de JJ (Johnson et Johnson), lequel utilise une recette semblable à celle d’AZ.
- 22 avril 2021 : La FDA fournit des détails de son inspection faite entre le 12 et le 20 avril 2021 chez Emergent Biosolutions’. Elle mentionne qu’au niveau de l’usine il y avait une supervision insuffisante, des situations non-sanitaires, tels l’écaillage de la peinture sur les murs et au plafond, des dépôts noirs et brunâtres sur les planchers, du personnel insuffisamment formé et un protocole non suivi pour prévenir la contamination. Selon la FDA, tous ces facteurs étaient cependant sans relation avec la production des caillots.
- 2 avril 2021 : Un autre joueur apparaît dans la production de vaccins, soit la compagnie Valneva. Cette entreprise internationale est connue pour produire des vaccins et elle est présente dans six pays, dont le Canada. Son vaccin consiste en un virus inactivé hautement purifié, injecté comme adjuvant.
Donc chaque jour, on en apprend un peu plus mais on se pose aussi beaucoup de questions.
Les virus
Qu’en est-il du virus? Le propre d’un virus est de muter et il ne faut donc pas s’étonner des divers mutants que nous observons dans le monde. Les facteurs de mutation sont innombrables et la séquence des mutations est très variable. La vitesse des mutations varie beaucoup également. Idem pour la contagiosité et la sévérité des effets secondaires. Ajoutons à cela les nombreuses voies métaboliques des êtres humains, les variations des mutations en fonction de l’âge, de l’état physique et psychologique et des comorbidités. Nous comprendrons donc qu’il n’y a rien de prévisible et en particulier peu de présentations cliniques similaires en grand nombre à court terme.
Comprenons aussi qu’il n’y aura jamais de moment parfait pour déconfiner et qu’il y aura toujours des décès. Il en est de même pour les très grandes variétés de présentation clinique de la COVID-19 avec la persistance ou non à long terme de séquelles. L’avantage des vaccins est optimal si toute la population est vaccinée en même temps.
Compte tenu de ce qui précède, devons-nous nous faire vacciner? La décision est personnelle. Quant à moi, j’ai reçu ma première dose du vaccin le 26 mars 2021.
Le vaccin pourra-t-il éradiquer la COVID-19? Le virus finira-t-il par disparaître par lui-même avec le temps? Aurons-nous besoin d’une vaccination annuelle? Des questions auxquelles seul le temps répondra…
Jean Mailhot
Endocrinologue à la retraite
Près de vingt ans d’expérience avec l’industrie pharmaceutique (recherche clinique et consultations)
Co-fondateur et ancien rédacteur en chef médical de l’Actualité médicale

